Tamaño de los átomos.
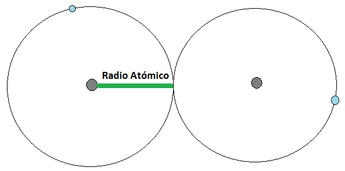
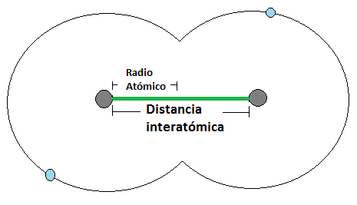
- Radio Atómico: El radio atómico se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentren unidos mediante un enlace (los enlaces atómicos se verán en detalle un poco más adelante). Para los átomos que se unan mediante una cesión de electrones, el radio atómico corresponde a la distancia indicada en la Imagen 12 (a) [izquierda], mientras que los que se unan mediante una compartición de electrones, el radió atómico se representa tal y como aparece en la Imagen 12 (b) [derecha]. Para esta consideración se considera al átomo como una esfera. El radio atómico aumenta a medida que se aumenta en el período y a medida que se baja en el grupo (Imagen 13).
Imagen 12: Radio Atómico. Las pelotas grises son los núcleos atómicos, mientras las bolas celestes son el electrón mas externo.
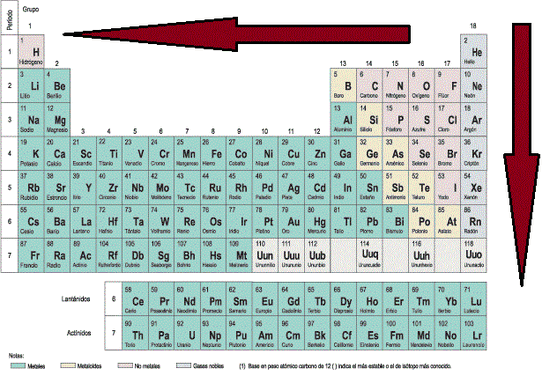
Imagen 13: Direcciones hacia donde aumenta el Radio Atómico.
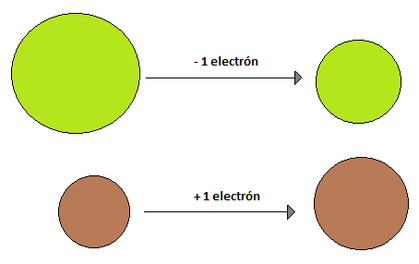
- Radio Iónico: El radio iónico se define en relación a iones. Un ion es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad superior debido a que sus niveles energéticos se encuentran completos. El término ion significa "ir hacia" y hace referencia a un circuito eléctrico, es por eso que las sustancias cargadas positivamente se llaman cationes (van hacia el cátodo, polo negativo) y las sustancias cargadas negativamente se llaman aniones (van hacia el ánodo, polo positivo). Pero, ¿Qué hace que exista esta especie química cargada? La respuesta es la ganancia o pérdida de electrones. Como un átomo es eléctricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones está dado por su electronegatividad, electro positividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativa, los electrones se sienten mucho más atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio (Imagen 14). El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ion (y algunos elementos tienen más de un ion posible, como Cu, Fe, Mn, etc.) (Imagen 15).
Imagen 14: Comparaciones entre los radios iónicos (derecha) con respecto a sus radios atómicos originales, (izquierda) para un elemento cualquiera que gane un electrón y otro cualquiera que pierda uno.
Imagen 15: Dirección hacia donde aumenta el radio iónico en la tabla periódica.
Llegando a este punto es preciso dar una justificación de porque estas dos propiedades periódicas aumentan en las direcciones indicadas y no en otra. Para poder comprender el porqué de este comportamiento es necesario incluir el término de carga nuclear efectiva (Zef). Partiremos definiendo la carga nuclear o número atómico. El número atómico (Z) es la cantidad de protones que contiene un núcleo atómico y se coloca al lado del símbolo químico del elemento (específicamente arriba a la izquierda del elemento). Otro valor que se encuentra es la masa atómica (A), el cual corresponde a la suma total de protones y neutrones del átomo y se localiza abajo a la izquierda del símbolo químico del átomo. Es decir, si consideramos el elemento J, todo esto se vería tal y como aparece en la Imagen 16 (a) y la Imagen 16 (b):
Imagen 16: (a) Escritura de un elemento genérico, incluyendo su Z y su A; (b) Escritura del elemento carbono, usando la simbología en (a).
Ahora bien, la carga nuclear efectiva o Zef es aquella fuerza atractiva "real" que ejerce el núcleo sobre el electrón más externo del átomo (puse "real" debido a que la Zef que calcularemos es un número aproximado). Mientras mayor sea el valor, quiere indicar que la fuerza de atracción núcleo-electrón es mayor, por lo que los electrones se encuentran más cercanos al núcleo atómico, reduciendo el radio atómico. Ahora nos dedicaremos a ver hacia donde aumenta la Zef (en general, porque claro, habrán ciertas excepciones). Para poder calcular la Zef se utiliza la siguiente fórmula:
Zef = Z - S
Considerando que:
S = 0,35 U.N + 0,85 PU.N + N
En donde U.N = cantidad de electrones en el último nivel energético, PU.N = cantidad de electrones en el penúltimo nivel energético y N = cantidad de electrones que no hayan sido considerados. A S se le denomina factor de apantallamiento o efecto pantalla, el cual consiste en las interferencias sufridas por el electrón más externo por parte de los electrones más internos. Esta interferencia está relacionada con la fuerza que se pierde en el trayecto desde el núcleo hacia el electrón más externo.
Ahora bien, teniendo todo lo anterior en cuenta, contamos con las herramientas suficientes para poder corroborar que el orden que se indicó anteriormente de crecimiento tanto del radio iónico como del atómico son correctos, para eso tomaremos el grupo 2 de la tabla periódica (Be, Mg, Ca, Sr, Ba, Ra) y el período 2 (Li, Be, B, C, N, O, F, Ne), lo que nos quedaría de la siguiente manera:
Partiremos con los radios atómicos de los primeros 4 elementos, tanto del grupo como del período a analizar:
Análisis de crecimiento en el Período 2
ZefLi: 3 - ([0,35 x 1] + [0,85 x 2]) ==> ZefLi: 3 - 2,05 ==> ZefLi: 0,95
ZefBe: 4 - ([0,35 x 2] + [0,85 x 2]) ==> ZefBe: 4 - 2,40 ==> ZefBe: 1,60
ZefB: 5 - ([0,35 x 3] + [0,85 x 2]) ==> ZefB: 5 - 2,75 ==> ZefB: 2,25
ZefC: 6 - ([0,35 x 4] + [0,85 x 2]) ==> ZefC: 6 - 3,10 ==> ZefC: 2,90
...
ZefLi: 3 - ([0,35 x 1] + [0,85 x 2]) ==> ZefLi: 3 - 2,05 ==> ZefLi: 0,95
ZefBe: 4 - ([0,35 x 2] + [0,85 x 2]) ==> ZefBe: 4 - 2,40 ==> ZefBe: 1,60
ZefB: 5 - ([0,35 x 3] + [0,85 x 2]) ==> ZefB: 5 - 2,75 ==> ZefB: 2,25
ZefC: 6 - ([0,35 x 4] + [0,85 x 2]) ==> ZefC: 6 - 3,10 ==> ZefC: 2,90
...
Como se puede apreciar, a medida que se avanza en el período, la carga nuclear efectiva, es decir, la fuerza atractiva entre el núcleo y el electrón más externo, se hace cada vez más fuerte, lo que provoca que los electrones estén más cerca del núcleo, disminuyendo su radio atómico, por lo tanto, se comprueba lo que se había dicho anteriormente.
Ahora analizaremos lo que ocurre en un grupo:
Análisis de crecimiento en el Grupo 2
ZefBe: 4 - ([0,35 x 2] + [0,85 x 2]) ==> ZefBe: 4 - 2,40 ==> ZefBe: 1,60
ZefMg: 12 - ([0,35 x 2] + [0,85 x 8] + 2) ==> ZefMg: 12 - 9,5 ==> ZefMg: 2,5
ZefCa: 20 - ([0,35 x 2] + [0,85 x 8] + 10) ==> ZefCa: 20 - 17,5 ==> ZefCa: 2,5
ZefSr: 38 - ([0,35 x 2] + [0,85 x 8] + 28) ==> ZefSr: 38 - 35,5 ==> ZefSr: 2,5
ZefBe: 4 - ([0,35 x 2] + [0,85 x 2]) ==> ZefBe: 4 - 2,40 ==> ZefBe: 1,60
ZefMg: 12 - ([0,35 x 2] + [0,85 x 8] + 2) ==> ZefMg: 12 - 9,5 ==> ZefMg: 2,5
ZefCa: 20 - ([0,35 x 2] + [0,85 x 8] + 10) ==> ZefCa: 20 - 17,5 ==> ZefCa: 2,5
ZefSr: 38 - ([0,35 x 2] + [0,85 x 8] + 28) ==> ZefSr: 38 - 35,5 ==> ZefSr: 2,5
Analicemos los resultados obtenidos. Si comparamos los Zef del Be y del Mg, veremos que hubo un incremento en el valor de éste, lo cuál significaría que el radio atómico disminuye, lo que va en contra de lo que se había dicho anteriormente (ver Imagen 13). Ahora, si vemos los demás valores, es notorio que los Zef de los elementos Magnesio (Mg), Calcio (Ca) y Estroncio (Sr) tienen el mismo valor, lo que indicaría que todos ellos tienen el mismo radio atómico. Veamos si es cierto, aquí les coloco los valores de los radios atómicos de los cuatro elementos químicos analizados arriba:
- Be: 0,90 Armstrongs
- Mg: 1,60 Armstrongs
- Ca: 1,97 Armstrongs
- Sr: 2,15 Armstrongs
(Valores obtenidos del Libro de Javier Guzmán, "Manual de Preparación PSU ciencias, módulo común obligatorio Química", Ed. Universidad Católica de Chile (2005).)
Como se pueden apreciar en los valores, el radio atómico si aumenta mientras se baja en el grupo, por lo cual, nuestros valores obtenidos deben tener algo errado o debe existir otra explicación para este hecho. Esta explicación es posible de ser encontrada no en Química, sino que en Física. Según la Física, dos cuerpos con cargas opuestas se atraen y dos cuerpos con cargas iguales se repelen, pero, ¿Cuánto se atraen o repelen?, para responder esta pregunta se utiliza la siguiente fórmula:
F = K (Q1 Q2)/ D2
En donde F = Fuerza electrostática, Q1 y Q2 = cargas de las partículas y D = Separación entre las partículas (en metros). K es una constante de proporcionalidad, cuyo valor ahora no nos interesa.
Como se puede ver en la fórmula, mientras más grande sea la distancia entre las partículas cargadas, menor será la fuerza atractiva entre ellas. Si llevamos esto a nuestro problema, veremos que a medida que aumentamos en un nivel de energía, el electrón se encuentra a una mayor distancia del núcleo, lo cual induce a que se sienta menos atraído hacia éste, quedando más libre y provocando un aumento del radio atómico. Esta explicación es válida también para el comportamiento del radio iónico en un grupo, ya que sufre el mismo fenómeno.
Ahora bien, si sacamos el Zef de algunos iones y los comparamos con sus átomos neutros, veremos que lo que se indica en la Imagen 14 se cumple a cabalidad. He aquí un ejemplo:
Be y Be2+: ZefBe: 1,60; y ZefBe2+: 2,30
C y C4-: ZefC: 2,90; y ZefC4-: 2,50
C y C4-: ZefC: 2,90; y ZefC4-: 2,50
Como se ve arriba, cuando un elemento se transforma en un catión, su Zef aumenta, disminuyendo el radio. En caso de que gane electrones su Zef disminuye, haciendo que el radio aumente. En la próxima sección veremos dos propiedades físicas más de los elementos: la densidad atómica y el volumen atómico.
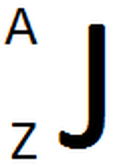
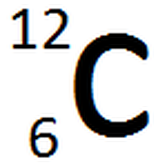
No hay comentarios:
Publicar un comentario